基本電化學腐蝕測量
介紹
大多數金屬腐蝕通過在金屬與溶液界面上發生的電化學反應而產生。對大氣腐蝕而言金屬表面薄的水分子層形成了溶液。大橋中的鋼筋發生腐蝕的電解液是潮濕的混凝土。盡管大多數腐蝕發生在水中,也有腐蝕發生在非水系統中。
腐蝕通常以正、逆反應達到平衡時的速率發生。首先是陽極反應,金屬被氧化,釋放離子至金屬表面。另一個是發生陰極反應,溶液中的離子(通常是O2 或 H+)被還原,吸收了來自金屬的電子。當這兩個反應達到平衡時,每個反應的電荷轉移速度相等,沒有凈電流產生。正、逆反應可發生在同一金屬或兩種不同金屬接觸。
圖1-1是上述過程的圖解。縱軸是電位,橫軸是電流的對數。理想的陰、陽極反應電流如圖中直線所示。曲線表示總電流—陰極電流和陽極電流之和。這是在用恒電位儀進行電位掃描時測得的電流。圖像中的尖點就是電流發生改變的地方,即反應從陽極反應轉變成陰極反應或是陰極反應轉變成陽極反應。尖點是由于將橫軸對數化造成。橫軸對數化是必要的,因為在一個腐蝕試驗中,較寬范圍內的電流值需展示在圖中。由于鈍化現象,電流值改變6個數量級不常見。
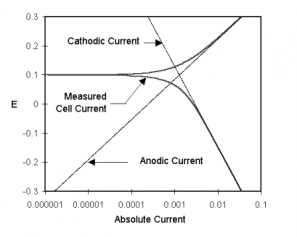
圖1-1 腐蝕過程中陽極和陰極電流部分
金屬電位 是陽極和陰極反應平衡時的電位。參照圖1-1。注意每個半反應的電流取決于金屬的電化學電勢。假設陽極反應產生過多電子只金屬表面。過剩電子使得金屬電位向負向移動,減緩陽極反應,加快陰極反應。這抵消了系統中的初始擾動。
在大多數腐蝕電化學試驗中,第一步就是測量開路電位。開路電位和腐蝕電位的關系通常可互換,但是更偏向于開路電位。
腐蝕科學家在測量開路電位很重要的一點就是在進行試驗前給予足夠時間使得開路電位達到穩定狀態。穩定的開路電位表示所要研究的系統處于穩定狀態,即各種腐蝕反應的速度恒定。有
些腐蝕反應在很短時間內達到穩定狀態,有些需要幾個小時。不管所需多少時間,電腦控制系統可以檢測開路電位使得測試在其穩定后進行。
開路電位時的陽極電流或陰極電流叫做腐蝕電流Icorr。如果可以測得腐蝕電流值,就可用其計算出金屬的腐蝕速率。但是腐蝕電流不能直接測得。然后,它可用電化學技術得到估算結果。在任何真實體系中,Icorr和腐蝕速率是包含多個系統變量的函數,包括金屬類型,溶液組成,溫度,溶液運動,金屬浸入溶液的時間,以及許多其他變量。
上述描述的腐蝕過程沒有提到金屬表面的狀態。實際上,許多金屬腐蝕后在其表面形成氧化物層。如果氧化層可抑制腐蝕進一步發生,則稱為金屬的鈍化。一些情況下,鈍化從局部破化使得在很小地方金屬發生明顯腐蝕。這種現象叫點蝕。
由于腐蝕通過電化學反應發生,電化學技術是一種理想的研究腐蝕過程的方法。在電化學研究中,用幾個平方厘米表面積的金屬試樣來模擬在腐蝕系統中的金屬。將金屬樣品浸入到與真實金屬腐蝕環境相似的溶液中。附加電極也浸入溶液中,所有電極連接到恒電位儀。恒電位儀可以控制改變金屬試樣的電位,測得電流。
控制電位(恒電位)和控制電流(恒電流)極化都很有用。當發生恒電位極化時,可測得電流,當發生恒電流極化時,可測得電位。這部分討論集中在控制電位模式,控制電位比控制電流更加常用。 除了開路電位對時間,電化學噪聲,電偶腐蝕和一些其他方法外,恒電位模式用于給腐蝕平衡過程施加擾動。當金屬試樣在溶液中的電位偏離開路電位時,被稱為試樣的極化。此時測得試樣的電流響應。這一響應過程可用來研究試樣的腐蝕行為。
假設用恒電位儀將電位極化至陽極區(開路電位正方向移動),看上述圖1-1。這將加快陽極腐反應速率(腐蝕),減小陰極腐蝕速率。因陽極反應和陰極反應速率不再相等,凈電流從電子電路流向金屬試樣。按照慣例這一跡象的電流叫正電流。關于電化學現象的慣例,可見此文件結尾部分。
如果將電位極化至足夠遠離開路電位,陰極反應電流可忽略不計,測得的電流即是陽極反應電流值。在圖1-1中,注意真實電流曲線和陽極電流在正無窮電位時位于彼此高處。相反,在負無窮電位時,陰極電流在整個電流中占主導地位。
在某些情況改變電位,首先使金屬鈍化,然后引起點蝕。測得電流對電位或對時間可以判斷在腐蝕電位下的腐蝕電流,發生鈍化的傾向,或者發生點蝕的電位范圍。
由于測量低腐蝕速率的能力以及進行試驗測量的速度優勢,電化學方法在研究腐蝕現象中的廣泛運用,使得電化學腐蝕測試系統在現代腐蝕實驗室中形成一個標準。
腐蝕定量理論
之前部分已指出腐蝕電流不能直接測得。許多情況下,可以從電流對電壓數據來估算腐蝕電流。在1.5V范圍內可以測得對數化電流對電位曲線。相對于開路電位進行電位掃描。將所測數據按腐蝕過程的理論模型來擬合。
假設發生在金屬表面反應的陽極和陰極過程均由電荷轉移動力學控制。這是腐蝕反應的通常情況。動力學控制的電化學反應遵循等式1-1 Tafel等式。
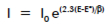
| I =反應電流 I0 =交換電流
|
Tafel方程描述的是一個孤立反應的行為。在腐蝕系統中,發生兩個正逆反應—陽極和陰極
在腐蝕系統中陽極和陰極反應的Tafel方程可結合成Butler-Volmer(式1-2)
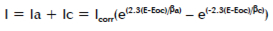 Equation 1-2
Equation 1-2
| I =測試電流 Icorr =腐蝕電流 E =電極電位 |
從式1-2中可以得到關于電流對電位曲線的什么信息?在開路電位時,每個指數等于1,因此與預期結果一致,測得電流值為0。開路電位附近的指數組成總電流。后,在恒電位儀控制下,電位遠遠偏離開路電位,其中一指數占主導地位,另一指數可忽略。此時,lgi和E之間呈線性關系。
Lgi對E圖稱作Tafel圖。圖1-1的Tafel圖可從Butler-Volmer關系直接得到。注意真實電流曲線線性區的范圍。
實際上,許多腐蝕體系是由動力學控制,因此服從等式1-2關系。在所研究的體系中,反應由動力學控制,lgi對E的曲線中在Ecorr的兩個方向都有線性區。然后,也存在復雜的情況,如:
- 濃差極化,反應速率由反應物到達金屬表面的速率控制。在電流較大時,當溶液中氧氣或氫離子的擴散速度沒有足夠快已保證動力學過程是控制反應速率,陰極反應表現出濃差極化現象。濃差極化更直觀的叫法是擴散控制。
- 氧化物的形成,可能或可能不導致鈍化層的形成,改變了金屬試樣的表面狀態。原始表面和改變后的表面可能會有式1-2中不同的常數。
- 引起表面狀態改變的還有如一種合金成分優先溶解的現象,也可以引起問題。
- 不止一個陰極反應或陽極反應的混合控制過程,反應同時發生使得模型變得復雜。混合控制的其中之一的例子就是同時發生氧氣和氫離子的還原過程。
- 后,在動力學控制模型下,電流流經溶液產生的電位降會引起錯誤。這一問題可以通過對恒電位儀通過IR補償進行校正。關于IR補償的討論,可以看Gamry關于IR補償的應用報告。
在大多數情況下,上述列舉的例子會引起Tafel圖沒有線性區。這一現象應予以重視。
經典的Tafel分析法是將lgi對E圖中線性區外推至交點。如圖1-2所示。交點處的陽極電流或陰極電流值就是腐蝕電流值。但是,真實腐蝕體系中不能提供足夠的線性區來進行準確的外推。現在大多數腐蝕測試軟件,如Gamry的DC105軟件,進行更加復雜的數值擬合至Butler-Volmer等式。通過調節Ecorr, Icorr, βa , and βc值將所測數據擬合至Butler-Volmer關系。這一擬合方法的優點是不需要足夠大的線性區域。
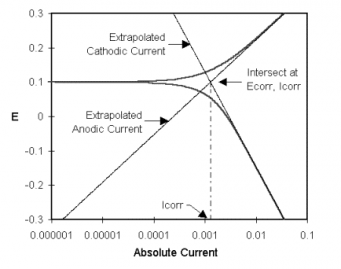
圖1-2 經典Tafel曲線分析
極化電阻
如果E非常接近于開路電位,則式1-2可以進一步簡化。接近開路電位時,電流對電位曲線可近似為直線。這一直線的斜率是電阻(歐姆)。因此此斜率稱為極化電阻Rp。由極化電阻值和Tafel系數經驗值可估算出腐蝕電流值。
如果將式1-2中的指數用冪級數展開項的前兩項近似替代并簡化,可以得到Stern-Geary公式:
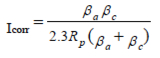 Equation 1-3
Equation 1-3
在極化電阻試驗中,在接近開路電位的范圍進行電位掃描(± 10 mV),記錄電流對電位曲線圖。在此范圍進行數據擬合可得到極化電阻值Rp。
極化電阻數據得不到Tafel系數相關信息。因此,要使用式1-3必須要知道Tafel系數。Tafel系數可由Tafel圖得到或可由經驗估算得出。
腐蝕電流計算腐蝕速度
通過擬合腐蝕數據獲得的數值結果就是腐蝕電流。腐蝕速率更加常用,如mm/a。腐蝕電流怎樣得到腐蝕速率?假設一溶液中電解反應涉及到一種化學物質,S:
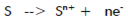
可通過法拉第定律將電流和質量聯系在一起。
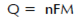 Equation 1-4
Equation 1-4
Q=反應產生的電量
n=電荷轉移數
F=法拉第常數
M=反應物摩爾數
式1-4更常用的形式運用到當量這一概念。當量是指反應物反應1摩爾電子的質量。對于原子種類來說,化學當量EW=AW/n(AW是原子質量)
得到M = W/AW,帶入式1-4得到:
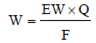 Equation 1-5
Equation 1-5
W是反應物質量
某系情況如金屬表面發生均勻腐蝕,腐蝕速率可用年單位來計算。注意,這一計算方法只適用于均勻腐蝕,當產生局部腐蝕時,這一方法得到的結果會大大低估問題!
對于一復雜合金發生均勻溶解時,此時的當量是每個合金成分當量的平均值。摩爾分數作為權重因子,而不是質量分數。如果發生不均勻溶解,可通過檢測腐蝕產物來計算當量。
失重可簡單地轉換為腐蝕速率。需要知道密度d,試樣面積A。電量Q可通過Q=IT得到,T是時間(秒),I是電流。代入法拉第常數。則將式1-5變為:
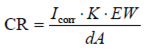 Equation 1-6
Equation 1-6
CR=腐蝕速率(mm/a)
Icorr=腐蝕電流(A)
K=常數
EW=當量(g/當量)
d=密度(g/cm3)
A=面積(cm2)
表1-1顯示的是式1-6中選擇不同腐蝕速率單位的常數K的數值。
Table 1-1. Corrosion Rate Constants
Corrosion Rate Units | K | Units |
mm/year (mmpy) | 3272 | mm/(amp-cm-year) |
milli-inches/year (mpy) | 1.288x105 | Milli-inches(amp-cm-year) |
參考ASTM G102做更深入了解。
IR補償
當電流經過兩個電極之間的導電溶液時,會引起溶液各部分電位分布差異。電位的整體變化與電極表面非常接近。這里電位梯度主要由于電極表面附近產生的濃度梯度。也有電流經過溶液電阻產生的電位降。
在電化學試驗中,希望控制或測得的電位是工作電極相對于參比電極的電位。通常不會注意溶液電阻引起的電位降。
和所有現代電化學儀器一樣,Gamry Series G或Reference 600都是三電極體系恒電位儀。測試和控制的是沒有電流經過的參比電極和其中之一電流流經的電極(工作電極)之間的電位差異。另一電流流經的電極(對電極)引起的電壓降沒有關系。
注意參比電極的放置位置對電流經過溶液電阻產生的電位降的影響。將參比電極看作在溶液中不同位置對電位進行采樣。離工作電極越近,由IR降引起的誤差越小。然而,由于電極有限的尺寸,在實際情況在并不能通過放置參比電極在溶液中的位置來*補償IR降。電池電阻除放置參比電極外剩余的稱為未補償電阻Ru。
Gamry恒電位儀采用電流中斷IR補償法來隨時修正未補償電阻帶來的誤差。電流中斷技術中,周期性的快速關閉一下電流。溶液中沒有電流經過時,IR降也隨之消失。電極表面的電位降在一個快速時間范圍內保持常數。有電流經過和沒有電流經過之間電位的差異就是未補償IR降。
每次獲取一個數據點時恒電位儀都會直接控制電流中斷。實際上有3個電位讀數: 電流被關閉之前的電位E1,電流關閉后的電位E2和E3。如圖1-3所示。由后兩個電位值推斷電位差值ΔE,回到電流被中斷的那一瞬時。中斷的時間取決于電流。大電流范圍時,中斷時間為40微秒。低電流范圍時,中斷時間持續長一點。

圖1-3 電流中斷時電位對時間圖
在控制電位模式中,有幾種方法可使施加電位隨時修正IR誤差。簡單的方法就是,采用上一個點的IR誤差來修正下一個點。例如,如果希望無IR降的電位是1V,上次測得的IR誤差是0.2V,恒電位儀則會施加1.2V電位。這一方法就是用上個點測得的誤差來修正下一點的施加電位。除了這一常用的補償模式外,Gamry PC4還提供取衰減曲線上兩個數據點的平均值這一更為復雜的反饋模式。
默認控制電位模式,通過電流中斷法修正施加電位測得電位誤差。在控制電流模式,則不需要修正。如果選擇IR補償模式,會從測得的電位中減去IR誤差。因此,所有記錄的電位都沒有IR誤差。
關于未補償電阻詳細的理論研究可查看Keith B. Oldham et al, Analytical Chemistry, 72, 3972 & 3981(2000)
電流和電壓的約定
在電化學試驗中電流的極性可以不一致。對于不同領域電化學研究者或不同國家甚至不同恒電位儀,-1.2mA的電流在意義都不一樣。對電化學分析家來說意味著1.2mA的陽極電流。對于腐蝕科學家來說意味著1.2mA的陰極電流。Gamry的恒電位儀默認的是腐蝕領域的公約,正電流表示陽極,負電流表示陰極。為了方便*用戶,Gamry恒電位儀可以通過簡單改變軟件命令來提供你偏愛的電流極性。
電位的極性也會產生混亂。在電化學腐蝕測試中,平衡電位可假設為開路電位。我們保留了腐蝕電位Ecorr這一項,也就是電化學測試中沒有電流流過時由電流對電位數據的擬合而定。理想情況下,Eoc 和Ecorr是*相同的。在掃描過程中電極表面的改變會引起這兩個數值的差異。
大多數恒電位儀,所記錄的電位都是相對于參比電極或開路電位的電位。前者表示為"vs. Eref",后者表示為"vs. Eoc"。將一種形式的電位改變為另一種的公式是:
E vs. Eoc = ( E vs. Eref) - Eoc
E vs. Eref = ( E vs. Eoc) + Eoc
不管是相對參比電極還是相對應開路電位,只使用其中一種。電位越正,陽極極化越嚴重,加速工作電極的氧化過程。相反,負電位加速還原反應。
腐蝕理論和電化學腐蝕測試的參考文獻
DC Electrochemical Test Methods, N.G. Thompson and J.H. Payer, National Association of Corrosion Engineers, 1440 South Creek Drive, Houston, TX 77084-4906. Phone: 281-228-6200. Fax: 281-228-6300. ISBN: 1-877914-63-0. Recommended!
Principles and Prevention of Corrosion, Denny A. Jones, Prentice-Hall, Upper Saddle River, NJ 07458 (1996). ISBN 0-13-359993-0. Recommended!
Polarization Resistance Method for Determination of Instantaneous Corrosion Rates, J. R. Scully, Corrosion,56, 199 (2000)
Several electrochemical techniques have been approved by the ASTM (American Society for Testing and Materials, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Phone: 610-832-9500. Fax: 610-832-9555, 3w.astm.org). They may be found in Volume 3.02 of the ASTM Standards:
G 5: Potentiostatic and Potentiodynamic Anodic Polarization Measurements
G 59: Polarization Resistance Measurements
G 61: Cyclic Polarization Measurements for Localized Corrosion Susceptibility of Iron-, Nickel-, and Cobalt-Based Alloys
G 100: Cyclic Galvanostaircase Polarization
G 106: Verification of Algorithm and Equipment for Electrochemical Impedance Measurements
G 108: Electrochemical Potentiokinetic Reactivation (EPR) for Detecting Sensitization
Electrochemical Techniques in Corrosion Engineering, 1986, National Association of Corrosion Engineers, 1440 South Creek Drive, Houston, TX 77084-4906. Phone: 281-228-6200. Fax: 281-228-6300.
Corrosion Testing and Evaluation, STP 1000, Edited by R. Baboian and S. W. Dean, 1991. American Society for Testing and Materials, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Phone: 610-832-9500. Fax: 610-832-9555. ISBN 0-8031-1406-0.
Electrochemical Corrosion Testing, STP 727, Edited by F. Mansfeld and U. Bertocci, 1979. American Society for Testing and Materials, 100 Barr Harbor Drive, West Conshohocken, PA 19428. Phone: 610-832-9500. Fax: 610-832-9555.
Corrosion and Corrosion Control, 3rd. Ed., Herbert H. Uhlig, John Wiley and Sons, New York, 1985.




